ISO13485标准解读
ISO 13485:2003 标准是以ISO 9001:2000《质量管理体系要求》标准为基础,采用了ISO 9000:2000 标准的质量管理理念,引用了ISO 9001:2000标准的结构、条款和格式,包含了ISO 9001:2000 标准的大部分质量管理体系的通用要求,以能确保医疗器械生产企业建立保持的质量管理体系具有持续稳定生产符合规定要求产品的能力。
ISO13485: 2003 标准概述
ISO13485: 2003 标准基本思想和特点
基本思想
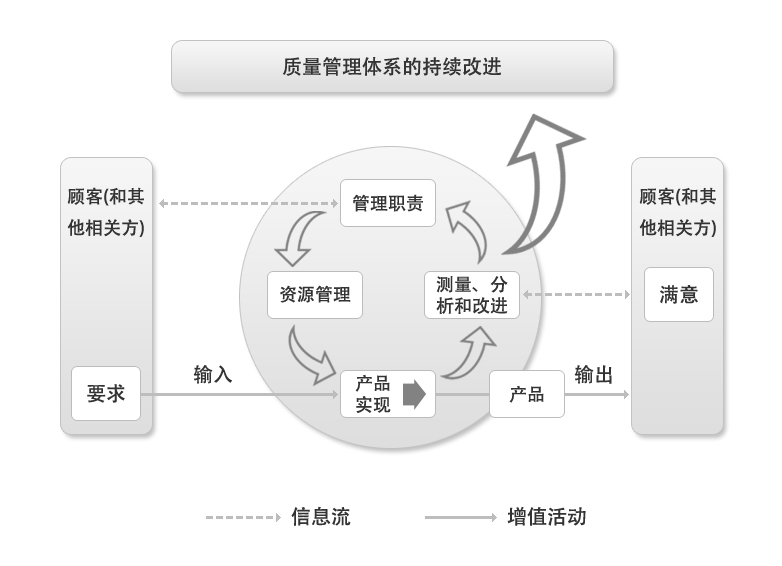
以ISO9001:2000标准为基础,提出质量管理体系是由相互关联的“管理职责”、“资源管理”、“产
品实现”、“测量分析改进”四大过程组成满足顾客要求;满足法规的要求。标准总计共有28 处提到法规要求,因此,满足医疗器械行政法规和技术
法规要求是医疗器械市场准入的基本条件。因此强调保持质量管理体系有效性是必要的。只有这样才能确保医疗器械的安全有效。医疗器械改进是需要的也是必要的,但要在符合法规的范围内进行,强调日常的频繁的持续改进,将可能背离法规,造成医疗器械不安全、无效的后果。因此强调“持续改进”对医疗器械是不适宜的。标准还指出:“顾客满意对于医疗器械法规的目标是不适当的,而且对组织生产安全和有效的医疗器械能力具有不利的影响”。“顾客满意”和“顾客感知度”作为法规要求来实施都过于主观医疗器械的生产是满足法规要求,而不应因顾客的满意和不满意去改变医疗器械。而按顾客满意与否随意地改变医疗器械是既背离法规也对生产安全有效的医疗器械产生不利影响。
促进全世界医疗器械法规协调为目标修订ISO 13485 标准。
主要特点
- 标准是仅适用于医疗器械行业的专业性强的独立标准
- 突出满足医疗器械法规的要求
- ISO 13485:2003 标准和ISO 9001:2000 标准存在不少差别。因此质量管理体系符合ISO 13485:2003 的组织不能声称符合ISO9001:2000 标准,除非其质量管理体系还符合附加的ISO 9001:2000 标准要求
- 标准继续明确文件化要求
- 标准继续强调文件化要求,标准中26 处提出形成程序文件的要求,有40 处提出记录要求
- 标准强调医疗器械专用要求
- 标准重视风险管理要求
- 标准指出“组织在产品实现过程中,建立风险管理的形成文件的要求。应保持风险管理引发的记录。”风
险管理与医疗器械组织的质量管理体系有关的活动和要求中的一个关键要求
- 标准指出“组织在产品实现过程中,建立风险管理的形成文件的要求。应保持风险管理引发的记录。”风
ISO 13485和 ISO 9000族标准的关系
ISO 9000族标准的是个核心标准:
ISO 9000: 2000 《质量管理体系 基础和术语》
ISO 9001: 2000 《质量管理体系 要求》
ISO 9004: 2000 《质量管理体系 业绩改进指南》
ISO 19011:2002 《质量或(或)环境管理体系审核指南》
以及支持性标准报告小册子
GB/T 19000族标准简介
质量管理体系基础
八项质量管理原则
以顾客为关注焦点
组织依存于顾客。因此,组织应当理解顾客当前和未来的需求,满
足顾客要求并争取超越顾客期望领导作用
领导者确定组织统一的宗旨及方向,他们应当创造并保持使员工能
充分参与实现组织目标的内部全员参与
各级人员都是组织之本,只有他们的充分参与,才能使他们的才干
为组织带来效益。过程方法
将活动和相关资源作为过程进行管理,可以更高效地得到期望的结果。管理的系统方法
将相互关联的过程作为系统加以识别,理解和管理,有助于组织提
高实现目标的有效性和效率。过程方法 管理的系统方法 关注过程中的活动 关注系统中的过程 将系统分解 将系统综合 属于战术,局部 属于战略全局 追求有效性 追求有效性和效率 n 是由哪几个别组成的 n 个1 相加大于n 持续改进
持续改进总体业绩应当是组织的一个永恒目标。- 值得注意的是在 ISO 13485 标准中删去了“持续改进”和“增强顾客满意”
两个词语,代之以“改进”和“持续满足顾客要求”。这是出于医疗器械的基本
要求是安全和有效。同时要符合法规要求,产品改进要分阶段进行,并按法规
手续审批,持续不断地改进和让病人满意对医疗器械来说是不现实的。
- 值得注意的是在 ISO 13485 标准中删去了“持续改进”和“增强顾客满意”
基于事实的决策方法
有效决策是建立在数据和信息分析的基础上。与供方互利的关系
组织与供方是相互依存的,互利的关系可增强双方创造价值的能力。
ISO 9000:2000主要内容
- 一部分是质量管理体系的术语
- 另一部分是质量管理体系基础
- 质量管理体系的理论说明
- 质量管理体系的要求和产品要求
- 质量管理体系方法
- PDCA
- 过程方法
- 质量方针和质量目标
- 最高管理者在质量管理体系中的作用
- 文件
- 质量管理体系评价
- 持续改进
- 统计技术的作用
- 质量管理体系与其它管理体系的关注点
- 质量管理体系与优秀模式之间的关系
质量管理原则、质量管理体系基础与GB/T 19000 族标准的关系
指导思想:管理哲学、理念 —> 承上启下:纳领、要点 —> 具体要求、活动指南
质量管理体系的基本术语和定义
- 质量 quality(3.1.1)
一组固有的特性满足要求的程度 - 要求 requirement(3.1.2)
明示的,通常隐含的或必需履行的需求和期望 - 特性 characteristic(3.5.1)
可区分的特征
- 产品 product(3.4.2)
过程的结果 - 过程 process(3.4.1)
一组将输入转化为输出的相互关联或相互作用的活动 - 程序 procedure(3.4.5)
为进行某项活动或过程所规定的途径
- 合格 conformity(3.6.1)
满足要求 - 不合格 nonconformity(3.6.2)
未满足要求 - 缺陷 defect(3.6.3)——–(它往往和安全与产品责任有关系,因此对缺陷一词应慎用)
未满足与预期或规定用途有关的要求
- 质量管理 quality management(3.2.8)
在质量方面指挥和控制组织的协调的活动 - 质量策划 quality planning(3.2.9)
质量管理的一部分,致力于制定质量目标并规定必要的运行过程
和相关资源以实现质量目标 - 质量控制 quality control(3.2.10)
质量管理的一部分,致力于满足质量要求 - 质量保证 quality assurance(3.2.11)
质量管理的一部分,致力于提供质量要求会得到满足的信任 - 质量改进 quality improvement(3.2.12)
质量管理的一部分,致力于增强满足质量要求的能力
- 质量管理体系 quality management system(3.2.3)
在质量方面指挥和控制组织的管理体系 - 管理体系 management system(3.2.2)
建立方针和目标并实现这些目标的体系 - 体系 system(3.2.1)
相互关联或相互作用的一组要素
- 有效性 effectiveness(3.2.14)
完成策划的活动和达到策划结果的程度 - 效率 efficiency(3.2.15)
达到的结果与所使用的资源之间的关系
相关方 interested party(3.3.7)
与组织的业绩或成就有利益关系的个人或团体
YY/T 0287—2003 标准的理解
一、概述
本标准规定了质量管理体系要求,组织可依此要求进行医疗器械的设计和开发、生产、安装和服务以及相关服务的设计、开发和提供
ISO 13485 是规定医疗器械组织质量管理的通用要求,而产品技术标准的特性是针对医疗器械实物的具体要求
二、引言 范围 规范性引用文件
三、术语和定义
四、质量管理体系
五、管理职责
六、资源管理
七、产品实现
7 产品实现 |